本期第一位主讲人为范小琳,硕士,工程师,主要从事生物毁伤效应研究工作。论文分享题目为:《姜黄素可减轻神经炎症,增强海马神经发生,改善创伤性脑损伤后的空间记忆》
主要内容
认知能力下降是创伤性脑损伤(TBI)最明显的症状之一。先前的研究表明,认知能力下降与TBI大鼠模型中海马中神经炎症的显着增加和神经发生减少有关。使用该模型,我们探讨了姜黄素(Cur)在改善TBI受损空间记忆中的作用,因为Cur已被证明具有抗慢性神经炎症、促进神经发生和改善记忆的特性。动物在TBI后每天接受Cur或载体治疗28天,并且还在治疗的前7天接受50-溴脱氧尿苷(BrdU)以测定神经发生。本研究使用了30 mg/kg的最佳Cur剂量,选自10-50 mg/kg的范围。通过星形胶质细胞肥大、活化的小胶质细胞和海马中的炎症因子评估神经炎症。行为水迷宫研究进行了5天,从TBI后35天开始。原肌球蛋白受体激酶B (Trkb)抑制剂ANA-12用于测试脑源性神经营养因子(BDNF)/TrkB/磷酸肌醇3-激酶(PI3K)/Akt信号通路在调节炎症和神经发生中的作用海马体。Cur治疗改善了TBI大鼠的空间记忆,减少了TBI引起的慢性炎症,其特征是星形胶质细胞肥大减少,活化小胶质细胞减少,炎症因子减少,海马神经发生增加。我们还发现BDNF/Trkb/PI3K/Akt信号通路参与了Cur对TBI大鼠的影响。因此,Cur治疗可以改善TBI小鼠模型中的空间记忆,这可能归因于慢性神经炎症减少、海马神经发生增加和/或BDNF/Trkb/PI3K/Akt信号传导。
试验方法
1实验动物
体重250-280 g的8周龄成年雄性Sprague-Dawley大鼠。将大鼠饲养在温度和湿度受控的房间中,在恒定的12小时光照/黑暗循环下,随意提供食物和水。所有实验均符合ARRIV指南,并按照美国国立卫生研究院实验动物护理和使用指南(NIH出版物NO.8023,1978年修订)进行。
2研究内容
本研究进行了三项研究
j第一项研究探索了最佳Cur剂量,范围从10到50 mg/kg,以减少TBI后的炎症和增加神经发生。大鼠随机分为以下五组:(1)TBI-VEH;(2) TBI-Cur (10 mg/kg,i.p.);(3) TBI-Cur (20 mg/kg, i.p.);(4) TBI-Cur (30 mg/kg, i.p.);(5) TBI-Cur (50 mg/kg, i.p.)。大鼠在TBI后用Cur或VEH治疗28天。TBI后28天处死各组大鼠并通过蛋白质印迹(n = 5/组)和免疫荧光标记(n = 5/组)进行评估。
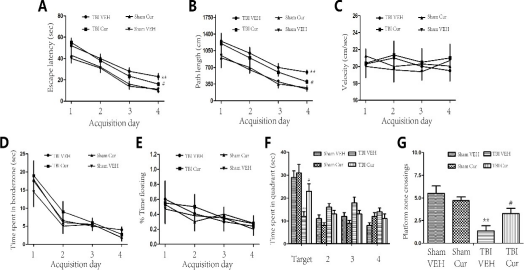
k第二项研究评估了TBI后Cur (30 mg/kg, i.p.)的效果。将大鼠随机分为以下四组:(1)ShamVEH;(2) Sham-Cur (30 mg/kg, i.p.);(3) TBI-VEH;(4) TBI-Cur (30 mg/kg, i.p.)。使用Morris水迷宫(n = 10/组)和免疫组织化学(IHC)和免疫荧光(IF)标记(n = 5/组)完成测试。此外,在TBI后7天注射50-溴脱氧尿苷(BrdU) (50 mg/kg, i.p.) (Kodali et al., 2018; Wang et al., 2016)。大鼠在TBI后用Cur或VEH治疗28天。大鼠从35天开始接受莫里斯水迷宫5天。TBI后的一天。TBI后35天处死各组大鼠。
l第三项研究测试了BDNF/Trkb/PI3K/Akt信号在调节TBI后慢性炎症和神经发生中的作用。将大鼠随机分为以下四组:(1)Sham-VEH;(2) TBI-VEH;(3) TBI-Cur (30 mg/kg, i.p.);(4) TBI-Cur-ANA-12(Trkb抑制剂)。测试包括IHC和免疫荧光标记(n = 5/组)和蛋白质印迹(n = 20/组)。大鼠在TBI后用Cur或VEH治疗28天。分别于TBI后7、14、21、28天处死各组大鼠进行Western blotting。TBI后28天处死各组大鼠进行IHC和免疫荧光标记。
3实验性TBI模型
用4%异氟醚诱导手术麻醉水平,采用无菌程序,在中线头皮切口,暴露颅骨,并用手持环钻在右半球进行颅骨切除术(直径6毫米)。骨瓣被移除,通过颅骨切除术将冲击尖端居中并降低,直到它接触硬脑膜,然后缩回杆并推进冲击,产生中度至重度脑损伤(2.4 m/s时8 mm组织变形)。撞击后立即停止麻醉,并迅速关闭切口。假大鼠接受了所有的外科手术,除了冲击。通过快速断头在麻醉下处死大鼠。大脑被收获并储存在4%多聚甲醛或-80 °C用于后续分析。
4结果
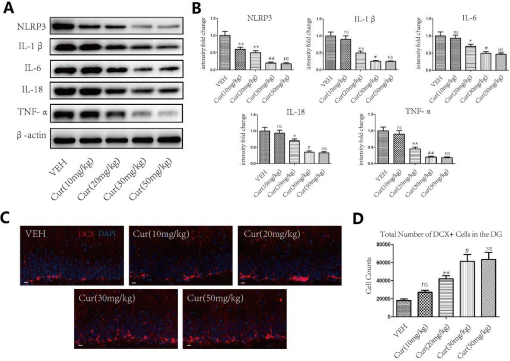
4.1 30 mg/kg剂量的Cur治疗对于增强海马神经发生和减少海马神经炎症是最佳的
4.2 Cur治疗的TBI大鼠表现出改善的海马依赖性空间记忆
4.3 Cur治疗可减少TBI后的海马神经炎症
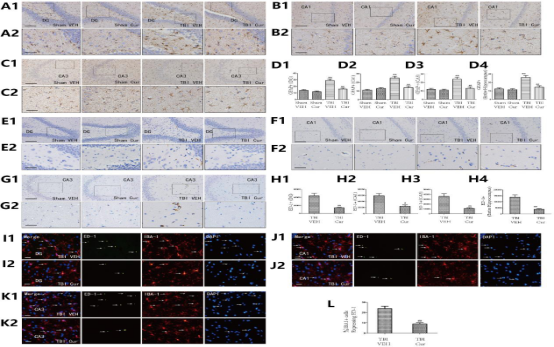
4.4 Cur增加TBI后DG的神经发生
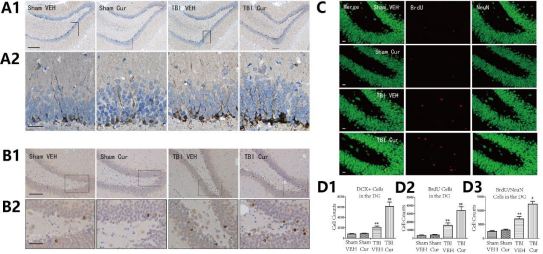
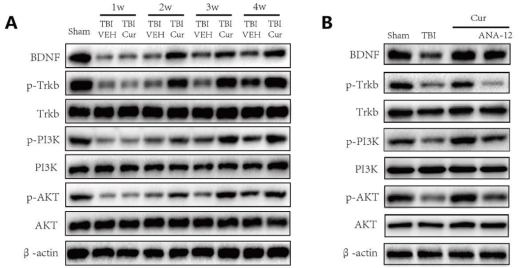
4.5 BDNF/Trkb/PI3K/Akt信号通路参与Cur对TBI大鼠的影响
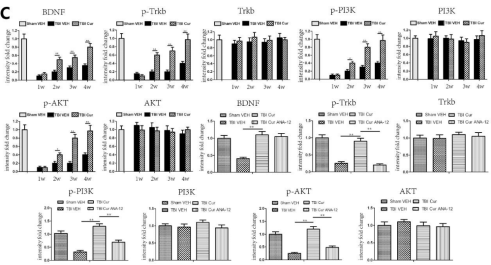
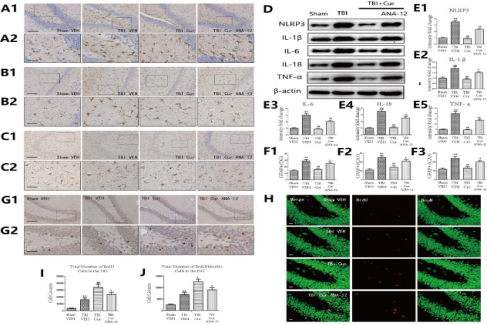
4.6拮抗TrkB后Cur对TBI的影响降低
5讨论
经证实,腹腔注射Cur可改善接受TBI的啮齿动物的急性神经炎症(Zhu et al., 2014)。在当前的研究中,首次证明腹腔注射Cur通过减轻慢性神经炎症和增强实验性TBI后的海马神经发生来改善认知功能。本研究中使用的Cur剂量的选择是基于先前几项研究中观察到的结果,这表明相对较低剂量的Cur可有效增强不同动物模型中的海马神经发生、减少炎症和增加认知功能。较低剂量的Cur采用的腹膜内途径也适合治疗性性TBI(28天)。最后,发现30 mg/kg剂量是增强海马神经发生和减少TBI后海马炎症的最佳剂量,在本研究中的所有其他实验中都使用了这个剂量。然而,尚不清楚Cur对TBI中抗炎、促进神经发生和认知功能的调节是否通过BDNF/TrKB/PI3K/Akt信号通路起作用。因此,本研究证明了BDNF/Trkb/PI3K/Akt信号通路参与了Cur在TBI大鼠中的作用。我们发现Cur在TBI后增加了BDNF/Trkb的表达并激活了PI3K/Akt信号传导,所有这些都通过与ANA-12的共同治疗而被消除。使用ANA-12后,Cur对TBI的影响降低。这些降低的作用包括炎症因子减少、肥大星形胶质细胞减少、BrdU阳性细胞增加和BrdU/NeuN阳性细胞增加,这证明Cur治疗TBI的潜在机制涉及调节BDNF/TrKB/PI3K/Akt信号通路。
6结论
本研究表明,Cur治疗可改善TBI大鼠模型的海马功能。Cur治疗大鼠海马中的一些细胞和分子变化似乎是这些功能益处的基础。这些变化包括肥大星形胶质细胞减少、活化小胶质细胞数量减少、炎症因子活化减少和神经发生增强。我们的研究还探索了最佳Cur剂量和可能的机制,BNDF/Trkb/PI3K/AKT信号可能通过这些机制调节这一过程。
本期第二位主讲人为邓辉,硕士,助理工程师,毒理应用技术研究室,主要从事含能材料毒理学研究工作。
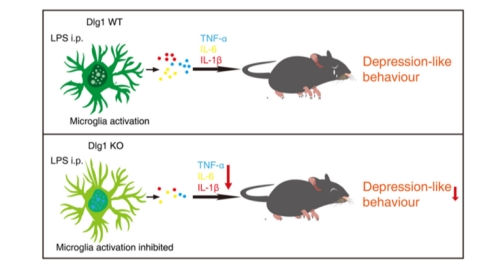
本期文献分享主题为:Dlg1基因敲除抑制小鼠小胶质细胞活化并减轻脂多糖诱导的抑郁样行为
(Peng Zhixin,Li Xiaoheng,Li Jun et al. Dlg1 Knockout Inhibits Microglial Activation and Alleviates Lipopolysaccharide-Induced Depression-Like Behavior in Mice.[J] .Neurosci Bull, 2021, 37: 1671-1682.)
主要内容
抑郁症(depression)是一种严重的精神疾病,普遍存在于各个年龄段,患病人数众多,抑郁症会显著增加自杀的风险以及诱发身体疾病。先前研究报道神经炎症是情绪障碍的危险因素,尤其在抑郁症患者中观察到有神经炎症发生,包括激活的小胶质细胞和炎性介质的释放。小胶质细胞介导的神经炎症被广泛认为是导致许多神经系统疾病和精神障碍(包括抑郁症)的重要原因。Discs large homolog 1(简称Dlg1),属于相关鸟苷酸激酶家族,其作为一种衔接蛋白,参与调节细胞极化和K+通道,同时K+通道在小胶质细胞的激活中发挥了重要调节作用。 然而,关于Dlg1在小胶质细胞和中枢神经系统稳态维持中的作用却不清楚
在本文中,研究人员发现Dlg1的下调可以通过下调小胶质细胞中NF-κB信号通路和丝裂原激活蛋白激酶通路的激活来抑制脂多糖(LPS)诱导的炎症反应。
此外,使用诱导的Dlg1小胶质细胞特异性敲除(Dlg1flox/flox;CX3CR1CreER)小鼠系中,发现敲除小胶质细胞Dlg1可减少小胶质细胞的激活,减轻LPS诱导的抑郁样行为。综上所述,Dlg1在小胶质细胞激活中起着至关重要的作用,此研究为临床治疗抑郁症提供了一个潜在的治疗靶点。