前言
本期第一位主讲人为刘志永,副主任医师,主要从事含能材料毒理学研究工作。本期文献分享主题为:多组学方法揭示CNTs和CIP对大肠杆菌毒性的拮抗作用及分子机制(Multi-omics analyses reveal molecular mechanisms for the antagonistic toxicity of carbon nanotubes and ciprofloxacin to Escherichia coli)
主要内容
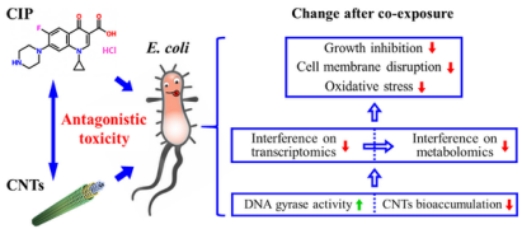
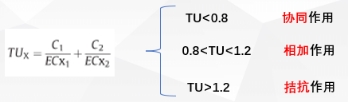
随着生产和应用的增加,工程纳米材料(ENMs)被排放到环境中,与共存的污染物相互作用,对生物体造成复杂的联合毒性。本研究选择典型的ENMs碳纳米管(CNTs)和常用抗生素环丙沙星(CIP),通过生物化学、转录组学和代谢组学方法研究它们对大肠杆菌的联合毒性。研究结果发现CNTs和CIP对细菌生长抑制有拮抗作用,毒作用机制包括细胞膜破坏和氧化应激。CNTs缓解了CIP对基因表达的干扰,尤其是与氮化合物代谢、氧化还原酶活性和铁硫蛋白成熟有关的基因表达。此外,CNTs通过调节不饱和脂肪酸的生物合成以及某些氨基酸和谷胱甘肽的代谢抵消了CIP对细菌代谢的影响。这一发现为ENMs及环境污染物产生联合毒性效应的分子机制提供了新的线索,并为环境中CNTs和氟喹诺酮类药物的风险评估提供了重要信息。
前言
本期第二位主讲人为马宁,硕士,助理工程师,生物效应技术研究室,主要从事生物毁伤研究工作。本期文献分享题目为:脑脊液中的pNF-H是急性和慢性爆炸诱发的创伤性脑损伤的生物标志物(Phosphorylated Neurofilament Heavy Chain in the Cerebrospinal Fluid is a Suitable Biomarker of Acute and Chronic Blast-Induced Traumatic Brain Injury)。
DOI: 10.1089/neu.2021.0144
本期精彩
神经丝(NFs)是维持神经元细胞骨架完整性必不可少的蛋白质。根据分子量不同,NFs分为轻(NF-L)、中(NF-M)和重(NF-H)链蛋白。NFs的特性和功能受蛋白激酶和磷酸酶催化的氨基酸磷酸化的调节。NFs过度磷酸化会影响轴突运输。
神经元特异性磷酸化神经丝重链蛋白(pNF-H)已被成功评估为不同神经系统疾病和不同脑损伤急性阶段的可靠生物标志物。在该研究中,通过构建单次和重复爆炸暴露实验大鼠模型,评估了爆炸暴露后不同时间大鼠脑脊液(CSF)中的pNF-H水平作为急性和慢性脑损伤生物标志物的效用。
主要内容
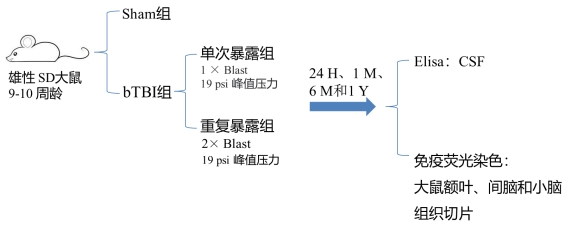
该研究数据显示,bTBI大鼠CSF中的pNF-H水平在24小时显著增加,在1个月时恢复到正常水平,但在爆炸后6个月和1年再次增加。单次和重复爆炸暴露组之间无显著差异。为了确定CSF中pNF-H的增加是否与其在大脑中的水平相对应,进一步在四个不同时间点对不同大脑区域的脑组织进行了免疫荧光组织化学染色。结果显示,在24小时、6个月和1年,以上脑区的pNF-H水平显著降低。表明爆炸暴露会导致急性和慢性轴突变性,引起pNF-H(一种丰富的神经元细胞骨架蛋白)的释放。此外,CSF中pNF-H水平变化与大鼠的神经行为功能呈负相关。因此,CSF中的pNF-H的水平可以作为bTBI诊断和预后的生物标志物。
